Von den Löchern im Periodensystem
Vor 150 Jahren, im März 1869, erfand Dmitri Mendelejew das Periodensystem der Elemente. Im Gespräch mit dem emeritierten Chemie-Professor Heinz Gäggeler hat «uniaktuell» allerhand Interessantes über die Elemente von 1 Wasserstoff bis 118 Oganesson erfahren.
Vor 150 Jahren wurde das Periodensystem erfunden. Wie ist diese Erfindung einzuordnen und was hat sie damals ausgelöst?
Heinz Gäggeler: Dmitri Mendelejew war damals Professor für technische Chemie an der Universität Sankt Petersburg. In der Vorbereitung eines Skripts für eine Chemie-Vorlesung überlegte er sich, wie man die chemischen Elemente – es waren damals rund 60 – übersichtlich in ein Schema einordnen könnte. Vor ihm hatten das bereits mehrere Leute versucht. Mendelejew machte aber ein entscheidendes Eingeständnis: Sein Periodensystem hatte noch viele Löcher. Wenn sich also sein Vorschlag zur Ordnung der Elemente in Perioden und Gruppen als richtig erweisen würde, dann gab es noch viele unentdeckte Elemente. Mendelejew publizierte sein Periodensystem 1869 und nochmals 1871 in einer zweiten Form, die dem heutigen System schon sehr ähnlich sah. Danach gab es einen regelrechten «Run» auf die unentdeckten Elemente. Und siehe da: man konnte innert rund 20 Jahre faktisch alle Löcher füllen. Das war der grosse Verdienst des Mendelejewschen Periodensystems und deshalb hat es sich auch durchgesetzt.

Was waren die wichtigsten Meilensteine beim «Run» auf die neuen Elemente und auch bei den Entdeckungen danach?
Es gab im Wesentlichen drei Schritte. Erstens war bei der Erfindung des Periodensystems die ganze Gruppe der Edelgase noch nicht entdeckt. Hier ist der schottische Chemiker William Ramsay zu nennen, der Ende des 19. Jahrhunderts fünf dieser Elemente entdeckte: Argon, Krypton, Xenon, Neon und Helium. Dafür erhielt er 1904 den Nobelpreis. Der zweite Schritt betrifft die Actinoide, die nach Element 89 Actinium kommen. Diese radioaktiven Elemente waren auch noch nicht in Mendelejews Periodensystem enthalten. Zudem waren die ersten Actinoide – Thorium, Protactinium und Uran – vor dem zweiten Weltkrieg an einem ganz anderen Ort des Periodensystems angeordnet. Sie galten damals noch als Übergangsmetalle, und zwar weil Thorium ähnlich war wie Hafnium, Protactinium wie Tantal, sowie Uran wie Wolfram. Während des zweiten Weltkriegs schlug der US-amerikanische Chemiker Glenn Seaborg vor, die neue Gruppe der Actinoide einzuführen. Er entdeckte auch etliche dieser Actinoide und wurde dafür ebenfalls mit dem Nobelpreis ausgezeichnet. Die dritte Erweiterung kam von Marie Curie. Aufgrund ihrer Untersuchungen wurden die Elemente zwischen 83 Bismut und 92 Uran entdeckt. Die wichtigsten waren Polonium und Radium, die Marie Curie selbst entdeckt hatte. Und ja, auch sie erhielt dafür den Nobelpreis.
Was muss man eigentlich tun, wenn man ein Element entdeckt hat?
Das ist ein wichtiger Aspekt, auch historisch gesehen. Es gab oft Entdeckungen, die sich nicht bewahrheitet haben. Hierfür gibt es die IUPAC (International Union of Pure and Applied Chemistry). Das ist sozusagen die UNO der Chemie. Dort gibt eine Kommission, die «Discovery Claims» evaluiert. Ich war selbst einige Jahre Mitglied dieser Kommission. Wenn die Kommission einen Claim für berechtigt hält, schlägt sie vor, dass man die Entdeckung möglichst an einem anderen Ort reproduziert. Weil solche Entdeckungen oft Resultat sehr komplizierter Experimente sind, kann das sehr lange dauern. 10 Jahre und mehr sind keine Seltenheit. Wenn dann die Reproduktion erfolgreich ist, bestimmt dann eine andere, die Namenskommission der IUPAC, wie das Element heissen soll. Die Namensgebung hat oft politische Hintergründe – wie zum Beispiel beim Element 113 Nihonium. Es wurde am RIKEN-Institut in Japan entdeckt und trägt daher «Nihon» im Namen – den Ausdruck für Japan in der Landessprache.
Es gab immer wieder Diskussionen darüber, ob alle Elemente im Periodensystem richtig eingeordnet sind. Wie ist der Stand heute? Hat alles seinen richtigen Platz?
Ja, mit einer Einschränkung. Dies betrifft die allerschwersten Elemente. Dort gibt es einen zunehmenden Einfluss von relativistischen Effekten auf die Chemie. Es fängt sozusagen Albert Einstein an, dreinzureden. Damit hat es folgende Bewandtnis: Mit der Ordnungszahl der Elemente nimmt die Anzahl Protonen im Atomkern zu. Das bedeutet, dass die positive Anziehung des Atomkerns auf die Elektronen, die um ihn kreisen, immer grösser wird. Deshalb «sausen» die Elektronen immer schneller um den Kern, um nicht hineingesogen zu werden. Und wenn sie schneller werden, dann verändern sich auch ihre Masse gemäss der Relativitätstheorie und als Konsequenz ihre Bahnen – sie kommen dem Kern immer näher und haben immer höhere Bindungsenergien. Das hat Auswirkungen auf die Chemie, die im Grunde nichts anderes ist als die Auswirkung des Verhaltens der Elektronenbahnen auf die Aussenwelt. Ob man zum Beispiel eine chemische Verbindung zwischen Elementen machen kann, hängt von den Elektronen ab. Weil nun dieser relativistische Effekt wegen des sogenannten Coulombgesetzes im Quadrat zur Ordnungszahl stärker wird, nimmt er für schwere Elemente ab etwa der Ordnungszahl 80 sehr stark zu. Das führt dazu, dass sich die schwersten Elemente plötzlich sehr seltsam verhalten. Ein Beispiel ist das allerletzte Element, Oganesson 118. Es sollte eigentlich ein Edelgas sein. Aber neuste Berechnungen zeigen, dass es ein Metall sein sollte, das erst bei 150 Grad schmilzt. Man ist sich jetzt unsicher, ob man die Einordnung ändern soll – aber das wird sich zeigen.

Oganesson ist das bisher letzte, das 118. Element im Periodensystem. In der Natur kommt nur ein Teil der Elemente vor, der Rest kann nur künstlich erzeugt werden. Bedeutet das, dass die Entdeckung von Elementen unendlich weitergeht?
Nein, die Natur setzt hier Grenzen. 2011 hat der finnische physikalische Chemiker Pekka Pyykkö berechnet, dass das schwerste Element, das es überhaupt geben kann, die Atomzahl 172 hat. Was ist so speziell an dieser Zahl 172? Das hat genau mit diesen relativistischen Effekten zu tun, die ich angesprochen habe. Ab einer gewissen Ordnungszahl ist die Anziehung des Atomkerns auf die Elektronen so gross, dass sie nicht mehr um den Kern zirkulieren, sondern hineingesogen werden. Dann hat man keine Elektronenhülle mehr. Und wenn man keine Elektronenhülle mehr hat, hat man auch kein Atom mehr. Und wenn man kein Atom mehr hat, hat man keine Chemie mehr. Das ist das Ende des Periodensystems. Dieser Punkt ist bei Ordnungszahl 172 erreicht – zumindest nach den Berechnungen von Pekka Pyykkö.
Wann wird das 119. Element entdeckt?
Darum bemühen sich aktuell zwei Forschungsinstitute: RIKEN in Japan und das Vereinigte Institut für Kernforschung Dubna in Russland. Beide wollen allerdings versuchen, das Element 120 zu synthetisieren. Es ist einfacher, gerade Elemente zu synthetisieren als ungerade – dies hat kernphysikalische Gründe. Es wird aber spannend, weil die beiden Institute unterschiedliche Synthese-Reaktionen verwenden und man streitet sich darüber, welches die bessere ist. Man rechnet damit, dass sie zwei bis drei Jahre Strahlzeit an einem Beschleuniger benötigen. Dies ist ein enormer Aufwand, aber es könnte mit einer neuen Namensgebung enden!

Auch Sie haben sich in Ihrer Forschung mit superschweren Elementen befasst. Lohnt sich der enorme Aufwand?
Auf diese Frage habe ich zwei Antworten. Einerseits eine akademische: Den Einfluss der relativistischen Effekte auf die Chemie kann man anhand der «exotischen» schweren Elemente am besten bestimmen, weil sie am stärksten ausgeprägt sind. In viel kleinerem Masse treten diese Effekte aber natürlich auch bei leichteren Elementen auf. Dank der Forschung mit den schweren Elementen können dadurch Modelle der theoretischen Chemie verbessert werden. Diese Modelle kommen auch für die Berechnung von einfachen chemischen Molekülen zum Einsatz, beispielsweise in der Pharma-Industrie.
Die zweite Antwort betrifft die chemische Technologie, die man für diese Forschung benötigt. Ich habe in meiner Karriere hier in Bern 45 Doktorandinnen und Doktoranden ausgebildet. Bei der Forschung kamen sie mit Kolleginnen und Kollegen aus den Ingenieurswissenschaften und der Physik zusammen und haben monatelang mit computerkontrollierten Verfahren Apparaturen betrieben, die in einem Umfeld funktionieren mussten, die wegen der radioaktiven Strahlung an Beschleunigern nicht zugänglich waren. Dadurch haben sie sich viele Kompetenzen im interdisziplinären Arbeiten und im Chemical Engineering angeeignet. Diese Skills haben salopp ausgedrückt einen grossen «Marktwert». Sie sind in der chemischen Industrie sehr gefragt.
Wieviel hat die Universität Bern mit dem Periodensystem zu tun?
Bei der Entdeckung der Elemente hat die Schweiz leider nicht viel zu melden – obschon drei Elemente aus der Gruppe der seltenen Erden Ende des 19. Jahrhunderts von Genfer Forschern entdeckt wurden. In diesem Zusammenhang ist es auch interessant zu erwähnen, dass die Elemente ab Ordnungszahl 102 von Physikern entdeckt wurden und nicht von Chemikern. Die Physik kann aber nicht sagen, welche Eigenschaften ein Element hat und wo es im Periodensystem einzuordnen ist. Hier war die Berner Gruppe, die ich gemeinsam mit dem Paul Scherrer Institut geleitet habe, in den letzten 20 Jahren führend. Wir haben die Elemente 106 Seaborgium, 107 Bohrium, 108 Hassium, 112 Copernicium und 114 Flerovium erstmals untersucht und konnten sie in die entsprechenden Gruppen zuordnen. Vier dieser fünf «first ever chemical studies» konnten wir in Nature publizieren.
ZUR PERSON
Heinz Gäggeler ist emeritierter Professor des Departements für Chemie und Biochemie der Universität Bern und war vor seiner Pensionierung auch Bereichsleiter am Paul Scherrer Institut PSI.
Kontakt: heinz.gaeggeler@psi.ch
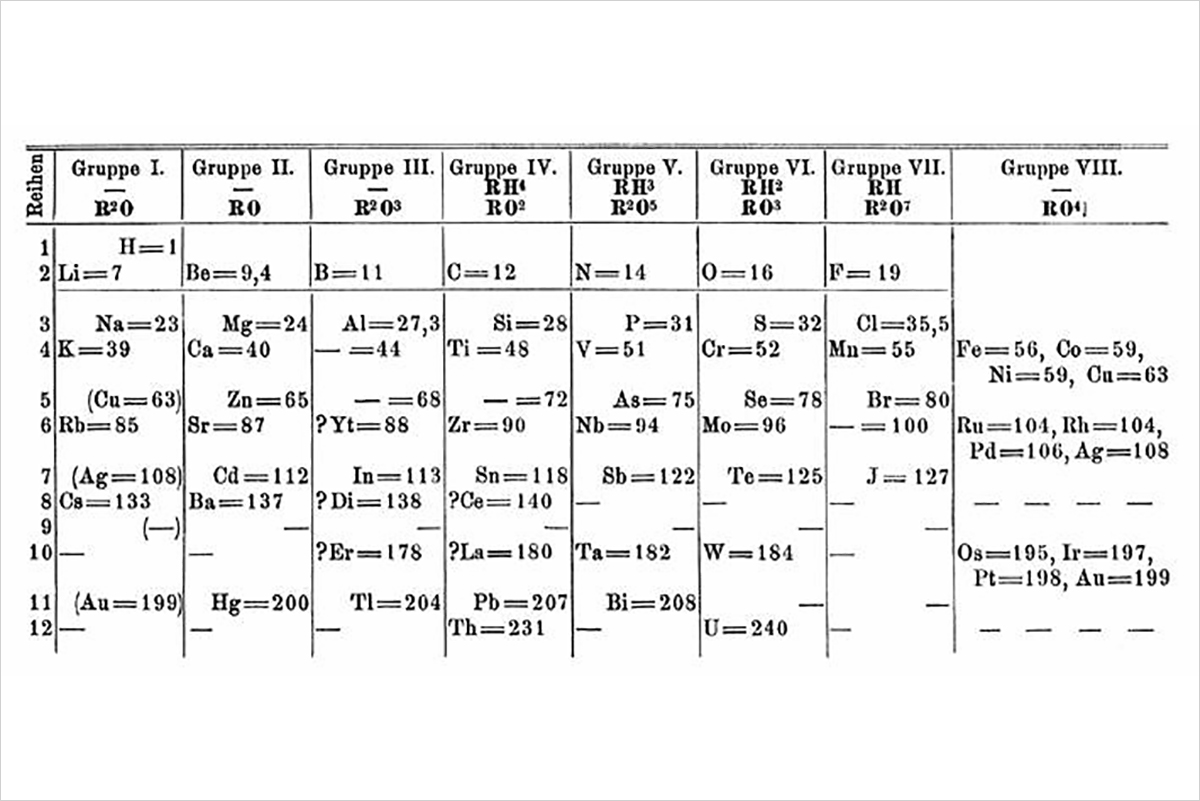
DAS PERIODENSYSTEM DER ELEMENTE
Das Periodensystem der Elemente stellt alle chemischen Elemente dar. Die aufsteigende Ordnungszahl der Elemente entspricht ihrer Kernladung (Anzahl positiv geladener Protonen im Atomkern).
Anhand der horizontalen und vertikalen Anordnung der Elemente im Periodensystem können verschiedene Informationen zu den Elementen abgelesen werden. Die horizontalen Zeilen (=Perioden) geben Auskunft über die steigende Anzahl mit Elektronen besetzter Elektronenschalen um den Atomkern der Elemente. Die innerste Elektronenschale, die K-Schale, kann von maximal zwei Elektronen besetzt werden. Daher gibt es auch nur zwei Elemente (1 Wasserstoff und 2 Helium), die in der ersten Periode stehen. Chemische Elemente, die zwei besetzte Elektronenschalen haben, stehen in der zweiten Periode usw.
Die vertikal angeordneten Haupt- und Nebengruppen fassen chemische Elemente zusammen, die ähnliche Eigenschaften haben.
Bis heute wurden 118 Elemente entdeckt oder erzeugt und beschrieben. In der Natur kommen die Elemente der Ordnungszahlen 1 bis 92 vor, zudem auch in geringen Spuren das Element 94 Plutonium. 84 dieser Elemente sind primordial, also seit der Entstehung der Erde existent. Weitere acht Elemente wurden aus den natürlichen Zerfallsreihen der primordialen Elemente Thorium und Uran gebildet. Zwei relativ leichte Elemente sind radioaktiv: Technetium mit der Atomzahl 43 und Promethium mit der Atomzahl 61. Die Elemente der Ordnungszahlen 93 bis 118 wurden künstlich erzeugt, ausser den erwähnten Spuren von Element 94 (Plutonium).
INTERAKTIVES PERIODENSYSTEM VON NATURE
Zum 150-jährigen Jubiläum des Periodensystems hat das Fachmagazin Nature ein interaktives Periodensystem lanciert. Darin sind interessante Forschungsarbeiten, Kommentare und Multimedia-Beiträge zu allen chemischen Elementen enthalten. Im Beitrag zu Gold findet sich auch eine Publikation von Dr. Ilya Pobelov vom Departement für Chemie und Biochemie der Universität Bern.
ZUM AUTOR
Ivo Schmucki arbeitet als Redaktor bei Media Relations und Corporate Publishing in der Abteilung Kommunikation & Marketing an der Universität Bern. Er ist Themenverantwortlicher «Natur und Materie».