Licht in Sicht: molekularer Lichtschalter gegen Blindheit
Berner Forschenden ist es gelungen, erblindeten Mäusen das Augenlicht zurückzugeben. Dazu haben sie noch intakte Zellen der Netzhaut biotechnologisch so modifiziert, dass sie als Ersatzfotorezeptoren die Rolle der abgestorbenen Lichtsensoren im Auge übernehmen.
Weltweit leiden etwa zwei Millionen Menschen an der vererbbaren und unheilbaren Augenkrankheit Retinitis pigmentosa. Nach und nach verlieren die Betroffenen ihr Augenlicht, da die Lichtrezeptoren der Netzhaut, die sogenannten Fotorezeptoren, absterben. «Auch wenn die Fotorezeptoren ihre Funktion verlieren, sind die darunter liegenden Nervenzellen, die normalerweise die visuelle Information erhalten und verarbeiten, noch voll funktionsfähig», erläutert Sonja Kleinlogel vom Institut für Physiologie der Universität Bern. «Diese verbleibenden Zellen kann man lichtempfindlich machen und sozusagen zu Ersatzfotorezeptoren umwandeln.»
Die Forschenden haben Mäuse, die von Geburt an unter Retinitis pigmentosa leiden, mit Hilfe dieses Ansatzes therapiert. Das Ergebnis: Die therapierten Mäuse konnten wieder Tageslicht sehen, auf visuelle Reize reagieren und durch Licht ausgelöste Verhaltensmuster erlernen. Die Studie wurde in der Fachzeitschrift «PLoS Biology» veröffentlicht.
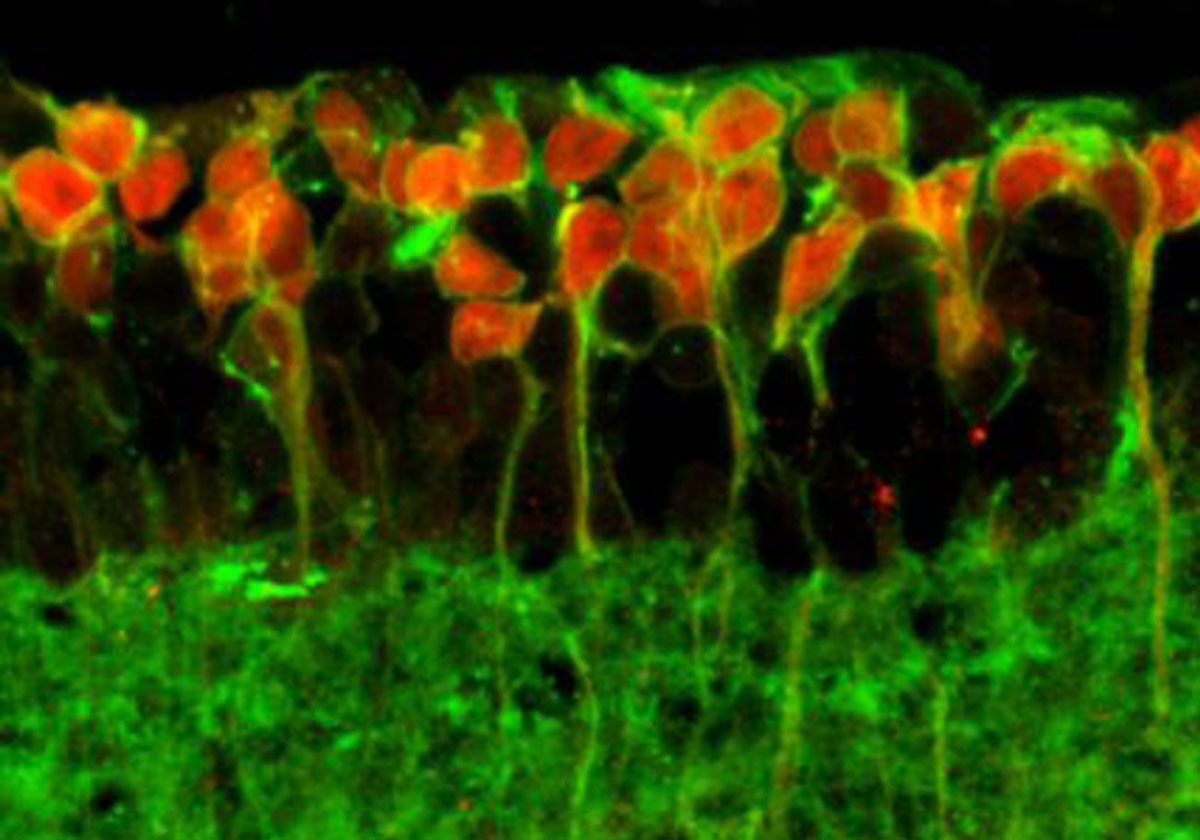
Eine neue «Lichtantenne» für die Netzhaut
Kleinlogels Team hat die sogenannten ON-Bipolarzellen, also die Nervenzellen, die sonst Informationen von den Fotorezeptoren erhalten, molekular umgebaut: Sie reagieren nun nicht mehr auf chemische, sondern auf Lichtreize. «Wir haben eine neue ‹Lichtantenne› in die Zelle integriert, was dazu führte, dass praktisch der ganze Lichtreiz verarbeitet werden konnte», erklärt Sonja Kleinlogel.
Konkret haben sie und ihre Kollegen den Rezeptor der ON-Bipolarzellen molekular so umgebaut, dass dieser nicht mehr auf den Botenstoff Glutamat, sondern auf Licht reagiert. Dieser künstlich hergestellte Fotorezeptor, Opto-mGluR6, besteht zum einen aus dem netzhauteigenen Lichtschalter Melanopsin, der für unseren Tag-Nacht-Rhythmus verantwortlich ist, und zum anderen aus dem ON-Bipolarzellrezeptor mGluR6, der im gesunden Auge via Glutamat Signale von den Fotorezeptoren erhält. «Wir haben einfach die Glutamat-Andockstelle des mGluR6-Rezeptors durch die Lichtantenne von Melanopsin ersetzt», führt Sonja Kleinlogel aus.
Den im Auge natürlich vorkommenden mGluR6-Rezeptor als Basis des molekularen Umbaus zu verwenden, hat laut der Forscherin einerseits den Vorteil, dass der normale Signalweg in den Bipolarzellen erhalten bleibt. Andererseits sehe die Zelle den neu zusammengesetzten Rezeptor Opto-mGluR6 als «eigen» und somit nicht als Fremdkörper an: «Da Melanopsin und mGluR6 beides natürlich vorkommende Proteine der Netzhaut sind, macht das eine Immunabwehr des Patienten äusserst unwahrscheinlich.»

Wie könnte Opto-mGluR6 in der Klinik eingesetzt werden?
Eine noch zu entwickelnde neue Therapiemethode könnte allen helfen, die durch den Verlust ihrer Fotorezeptoren erblindet sind, aber auch Menschen, die an altersbedingter Makuladegeneration (AMD) leiden; eine Augenkrankheit die jeden Zehnten über 65 zum gewissen Grad betrifft. «Der Hauptvorteil von Opto-mGluR6 ist, dass Patienten wieder normales Tageslicht sehen könnten, ohne lichtintensivierende oder bildumwandelnde Brillen tragen zu müssen», fügt die Forscherin an – ein Nachteil bisheriger, verwandter Therapieansätze, die auf dem Protein Channelrhodopsin statt auf Opto-mGluR6 basieren.
Der mGluR6-Rezeptor gehört ausserdem zur pharmakologisch bedeutenden GPCR-Rezeptorgruppe. GPCR-Rezeptoren sind auch im Gehirn weitverbreitet. Das biotechnologische Prinzip, einen neuen Rezeptor auf GPCR-Basis herzustellen, eröffnet daher laut Kleinlogel auch neue Möglichkeiten, Krankheiten des Gehirns wie zum Beispiel Angststörungen, chronische Schmerzen, Depression oder Epilepsie zu behandeln. Sie betont indes: «Es wird noch mindestens zwei bis drei Jahre in Anspruch nehmen, bis Opto-mGluR6 in der Klinik getestet werden kann.»